

中国肿瘤防治联盟
Union of Chinese Oncology Management
中国肿瘤防治联盟
Union of Chinese Oncology Management

癌细胞代谢的“特立独行”
细胞的新陈代谢是一个复杂精细的网络,包含着成千上万个有序的生化反应,反应过程中细胞得以生长、分裂并对外界环境做出反应。经过100多年的调查研究,人类已识别出约3000种酶和营养转运体。但直到最近,人们才明白癌细胞利用这些代谢成分来进行增殖和生长。
和非增殖性正常细胞不同,癌细胞代谢需求多种多样。每次分裂时癌细胞都必须复制自身组成成分,包括DNA、细胞器和脂质膜。癌细胞的快速增殖需要大量结构单元,以确保上述细胞成分的生成;而癌症细胞早有巧妙对策,确保结构单元取之不尽,用之不竭。鉴于许多癌症细胞的生长都依赖于代谢变化,人们对通过这些生化途径研究肿瘤治疗方法的兴趣在过去十年中日益高涨。尽管迄今为止市面上只有少数的治疗方法,但过去十年的基础研究已提出很多新方案,前景一片光明。其中一些已进入人体试验阶段,并且诊所已有运用该疗法的先例。
癌细胞的结构单元
20世纪20年代,德国生化学家奥托·瓦尔堡最先提出癌细胞代谢异常的理论。瓦尔堡使用自己发明的量热技术测量肿瘤细胞和正常细胞内两种主要方式产能情况:线粒体呼吸和糖酵解过程。他发现,正常细胞只有在缺氧状态下才会使用低效的糖酵解;而癌细胞则与之不同,即使氧气充足,它也会依赖糖酵解代谢。
人们已在多种肿瘤细胞中观察到这种现象,生物上称为有氧糖酵解,这一过程对葡萄糖有极大的依赖性。临床医生利用由癌细胞摄取的多余葡萄糖,为患者注入一种放射性化学葡萄糖类似物——18F-氟脱氧葡萄糖(FDG),并使用正电子发射断层显像技术(PET)进行葡萄糖人体位置追踪从而以更直观的方式观察癌细胞。
尽管有氧糖酵解是人们公认的癌细胞代谢方式,但研究人员对于癌细胞为何会采用这种更低效的能量代谢仍存在争议。瓦尔堡假设癌细胞内线粒体功能失调,故不得不依赖于糖酵解代谢过程提供能量,但很多癌细胞能够正常进行线粒体呼吸,这说明这些细胞器的功能仍然正常。此外,一些没有线粒体缺陷的增殖细胞同样进行糖酵解代谢并消耗掉大量的葡萄糖。
另一种假说指出糖酵解增多可能有助于癌细胞更容易积累起细胞快速繁殖所必需的代谢前体。例如,糖酵解的中间产物进入磷酸戊糖途径中,生成核苷酸和DNA所需要的合成前体。这些中间产物同样能够提供碳主链,以合成核苷酸和合成蛋白所需的多样性氨基酸(例如丝氨酸和甘氨酸)。(见插图)癌细胞携带的低活性丙酮酸激酶,会对糖酵解进行最后的催化。这一发现进一步验证了糖酵解中间产物在细胞增殖过程中的关键性作用。低活性丙酮酸激酶,也称PKM2,可减慢糖酵解过程,从而使更多生物合成中间产物得以积累并将其中一部分产物用来合成生化物。利用能够激活酶的小分子药物来提高PKM2 效率,明显会降低代谢前体的可用性并阻碍癌细胞的生成。
尽管对糖酵解的依赖越来越大,大多数癌细胞仍然需要活性较高的线粒体呼吸进行细胞增殖。但这似乎并不是因为需要能量,而只是需要一个氨基酸——天冬氨酸。它不仅是很多蛋白质的重要组成成分,也是核苷酸的合成前体。呼吸有障碍的癌细胞急缺天冬氨酸,并最终因此停止增殖。通过使用正向遗传组学和代谢组学,我们小组和麻省理工学院马特·范德·海登实验室最近发现,当癌细胞呼吸受阻时,天冬氨酸的含量会急剧下降。而想要使呼吸受阻的癌细胞恢复细胞增殖,只需添加天冬氨酸即可。
不仅是天冬氨酸,还会很多其它氨基酸以及脂类和核苷酸都是通过线粒体代谢产生的。构成这些成分的前体在线粒体中通过三羧酸循环持续生成,并被运输到细胞质中用于合成细胞成分。然而,在糖酵解率高的癌细胞中,只有一小部分葡萄糖会进入三羧酸循环;大多数癌细胞是由有氧糖酵解代谢形成乳酸,最终将乳酸排出到细胞外环境中。因此癌细胞就需要为克雷布斯循环提供其它的原材料——营养物质而不是葡萄糖。谷氨酰胺,除了在蛋白质合成中起作用,它还是碳和氮的一个主要来源,癌细胞通常用它供应三羧酸循环和其他代谢活动。因此,难怪一些类型的肿瘤会增加细胞内的谷氨酰胺转运蛋白和酶的数量从而更有效地获得和使用谷氨酰胺。谷氨酰胺代谢的小分子抑制剂目前正处在临床试验阶段,日后有可能成为谷氨酰胺代谢致癌的有效治疗方法。
“劫持”代谢途径
单细胞微生物的新陈代谢很大程度上是受细胞外营养物质的有效性控制的,与此不同的是,多细胞生物体中每一个细胞的新陈代谢都需要与整个生物体的需求协调发生作用。这种运行机制一方面是通过分子在血液中循环调节的,例如生长因子刺激细胞增殖的同时也在调节细胞对葡萄糖、谷氨酸盐和其他营养素的吸收。在癌细胞中,生长因子信号中的基因编码蛋白质通常会发生突变,导致包含这些基因的信息通路发生组成性激活。因此,癌症细胞开始积累独立于其可用的营养物质以及这些生长因子信号。
研究癌细胞代谢也加深了我们对癌症的理解,能够以更广的视角研究治疗方法。它不仅是一种遗传性疾病,还是一种代谢失调。
磷酸肌醇3-kinase (PI3K)通路就是这样一种常常影响癌细胞的通路,它能够根据胰岛素调节葡萄糖代谢水平。在正常生理机能中,胰岛素接收到PI3K信号,从而加强肌肉和脂肪等细胞组织内的葡萄糖吸收。在许多癌细胞中,PI3K信号通路中一些成分的突变会导致其发生变异性活化,使细胞能够不受胰岛素支配吸收大量葡萄糖。同样,另一个在正常细胞生长和增殖中起关键调节作用的转录因子Myc,在许多癌细胞中大肆发挥作用,刺激了相关基因在吸收和利用谷氨酰胺上的表达。
除了信号组件,越来越多的证据表明,代谢酶也可以突变并直接导致肿瘤的形成。例如,克雷布斯循环中的遗传缺陷如酶琥珀酸脱氢酶(SDH)和延胡索酸酯酶(FH)就会导致罕见的肾脏和内分泌癌症。编码这些酶的基因会起到抑癌因子的作用——一个突变等位基因通常与遗传有关,而随后体细胞中会产生第二个突变基因,从而导致癌症的形成。完全丧失这些酶会导致前期新陈代谢物的积累,例如琥珀酸和延胡索酸酯。另一个克雷布斯循环基因,异柠檬酸脱氢酶(IDH),会表现为癌基因;一个等位基因的突变就足够引发癌症的形成。然而,这种突变不仅不会损失细胞活性,还能在某种程度上改变酶的功能,产生另一种代谢合成物——2型羟戊二酸(2-HG)。虽然目前对这些代谢基因突变对肿瘤形成带来的潜在影响还不明朗,但人们认为相关代谢物的积累(琥珀酸、延胡索酸酯和2-HG)会破坏正常细胞表观遗传程序从而导致癌症发生(例如,改变DNA的甲基化作用)。
肿瘤环境
另一个影响癌细胞代谢的重要因素是他们的生活环境。在快速增长的肿瘤中,癌细胞总是频繁地需要氧气和营养物质,其中部分是由于渗漏和血管系统紊乱导致。低氧条件下,细胞的一种常见反应是激活一种被称为肿瘤缺氧诱导因子(HIF)的转录因子,它能够增强糖酵解酶和葡萄糖转录因子的活性并且将癌细胞代谢转化为醣酵解,从而减少细胞对线粒体呼吸以及对氧气的依赖。
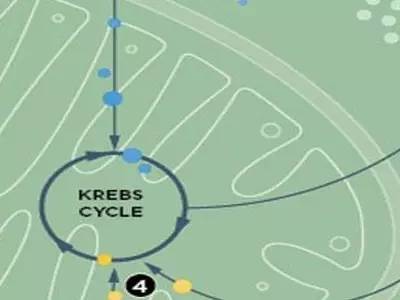
代谢重编程:为供给未被发现的增殖组织,癌细胞会经常对代谢进行调整,为细胞必要的保护屏障增加前体细胞供给物,如氨基酸、核苷酸和脂质。癌细胞代谢异常或有望成为癌症治疗新途径。
低氧环境下,需氧的代谢酶功能也会受到影响。例如,脂去饱和酶利用氧气形成碳双键从而使脂肪酸链“不饱和”。这些不饱和脂肪酸是形成原生质膜的关键成分,在其怜性和渗透性形成方面起着重要作用。通过阻止不饱和脂肪酸的形成,低氧水平导致饱和脂肪酸的积累,并阻碍细胞膜分子对细胞运输、信号和代谢活动进行的有效控制。为应对这种不平衡,许多肿瘤细胞从自身环境导入缺失的不饱和脂肪酸。在某些情况下,这些细胞脂质可以直接从附近脂质丰富的细胞中进行转运,如脂肪细胞。脂质饱和以及传输因此成为了在低氧条件下杀死肿瘤细胞的潜在目标。
增殖癌细胞还必须适应由于血液流动受损和营养物质的快速消耗所引起的营养物质(如葡萄糖和氨基酸)匮乏的情况。癌细胞的葡萄糖浓度通常远低于正常组织的葡萄糖浓度。大多数癌细胞为了应对葡萄糖不足,都“逆行其道”——从糖酵解转战线粒体呼吸,凭借电子传递链获取能量。因此,阻断呼吸可以阻止癌细胞在葡萄糖不足的条件下进行增殖。然而,一组胰腺癌细胞则另辟蹊径——吸收细胞外蛋白质,并将其分解为自身组成成分,以此应对营养物质不足。氨基酸是通过细胞膜转运蛋白进入细胞的,细胞外蛋白进入细胞的方式与此不同,它是通过一种名叫巨胞饮作用的方式进入细胞的——大块细胞外成分通过液囊进入细胞。然后,液囊与溶酶体结合,分解蛋白质,把游离氨基酸释放到细胞质中用于蛋白质合成。杭丁顿蛋白突变体刺激这一过程的发生,发出信号,忽视环境因素给予的停止分裂的提示。扰乱这种喂养机制以饿死或减缓这些难以治愈的癌细胞的增殖,这一策略是否可行还有待审视。
“瞄准”癌细胞代谢
近来有关癌细胞代谢不同于正常细胞的发现令研究人员激动不已,觉得以此途径为目标有望阻碍癌细胞生长。尽管新代谢疗法还未获批准,但是一些抗癌药物“前辈”表明这种疗法可能会极大地弥补现有疗法的不足。
早期抗癌代谢疗法研究工作的重点放在阻止合成新DNA。20世纪40年代,哈佛医学院的西德尼·法伯发现,服用叶酸——制造新核苷酸的关键维生素,会进一步恶化白血病。法伯推测,利用合成叶酸类似物(抗叶酸制剂)阻碍需叶酸酶发挥功能,以干扰叶酸代谢,有助于阻止癌细胞生长。这些药物能有效治疗白血病,已经得到了有力证明,并为化疗治疗癌症奠定了基础。如今,抗叶酸药物(如甲氨蝶呤)是乳腺癌和血癌化疗的常规用药。
某些血癌细胞依靠氨基酸天冬酰胺合成营养物质,再一次从临床层面有力地证明了“瞄准”癌细胞代谢的研究方向是正确的。正常细胞在天冬酰胺方面能自给自足,而血癌细胞则依赖于外部来源。1953年,康奈尔医学中心的约翰·基德及其同事们通过检测豚鼠血清对细胞增殖的影响,成为了发现癌细胞增殖依赖天冬酰胺的第一人。研究人员发现,在癌细胞培养细胞中加入豚鼠血清能强烈抑制癌细胞的增殖,因为一种叫做天冬酰胺酶的酶的出现,降解了细胞外的天冬酰胺。动物和人类注射了这种酶后,血液中的氨基酸会被耗尽,癌细胞会因天冬酰胺不足而饿死,而正常细胞则“幸免于难”。后来,通过离析细菌种群获得了疗效更好的天冬酰胺酶,并正用于血癌化疗。人类血清包含约5000种其他代谢物,是很多未知癌症的依赖物。限制这些营养物质的吸收或使用有可能在不影响正常细胞的情况下扰乱癌细胞增殖。
整个生物体的新陈代谢也会影响肿瘤代谢。人们通常认为肥胖和胰岛素耐受性会增加患癌症的风险,而最近研究表明,二甲双胍和苯乙双胍等抗糖尿病药物具有抗癌效果。最近,回顾以往针对二甲双胍的研究,收获颇丰。例如,一项研究显示患有糖尿病和胰腺癌的病人服用二甲双胍后,15%的人寿命延长了两年。这一疗法降低了癌症发病率可能是因为服用二甲双胍的病人循环胰岛素水平有所降低,因为胰岛素能通过PI3K通路促进癌细胞生长及养分的吸收。不过,最近研究发现,这些糖尿病治疗药物也直接发挥抗癌作用——通过阻断线粒体电子传递链的复杂组件,以减缓肿瘤生长。研究人员在动物模型肿瘤细胞中添加一个抗二甲双胍的酵母复杂蛋白质,减弱二甲双胍的抗癌效果——表明线粒体呼吸作用受到了直接影响。尽管二甲双胍具体是如何与肿瘤细胞相互作用的,仍无定论,但类似的“旧药新用”方法可能会成为有效的癌症治疗方法的研究方向。
癌细胞代谢研究的“复兴”为新疗法的研制增添了新鲜的血液,有些是“旧药新用”——如甲氨蝶呤和天冬酰胺酶,有些则是基于对个体癌细胞的代谢弱点的理解进行研究。研究癌细胞代谢也加深了我们对癌症的理解,能够以更广的视角研究治疗方法,它不仅是一种遗传性疾病,还是一种代谢失调。尽管早在一个世纪以前瓦尔堡就揭秘了癌细胞的代谢原理,但只有兴趣的重新兴起和新技术的应用,我们才得以把整个拼图放在一起。

扫一扫关注!

